Blog
Lascia che il cibo sia la tua medicina
e che la medicina sia il tuo cibo.
Ippocrate
Il ruolo primario che due dei sistemi più importanti del corpo svolgono nel mantenimento della nostra salute generale: il cervello (il sistema nervoso) e l’intestino (il sistema digestivo) è stato a lungo ignorato. Stiamo cominciando a capire che l’intestino, i microrganismi che lo popolano (microbiota) e le molecole segnale che producono grazie ai loro innumerevoli geni (microbioma) costituiscono un sistema trascendentale per la regolazione del buon funzionamento del corpo e del cervello. Il grande Ippocrate era sulla buona strada.
Il microbiota
Il microbiota è l’insieme dei batteri e degli altri microrganismi presenti in un dato ambiente. Il nostro microbiota si adatta a nicchie specifiche del corpo (bocca, piede o intestino, per esempio), distribuendosi in modo caratteristico e diverso in ogni persona, quindi dipende dall’ambiente in cui viviamo. Sebbene siano presenti microrganismi su tutte le superfici a contatto con l’esterno, gran parte risiede nell’intestino crasso. Pertanto quando si parla di microbiota si parla generalmente di microbiota intestinale. E’ quella che un tempo si chiamava flora intestinale, termine che non piace ai puristi poiché i nostri microrganismi non provengono dal regno vegetale.
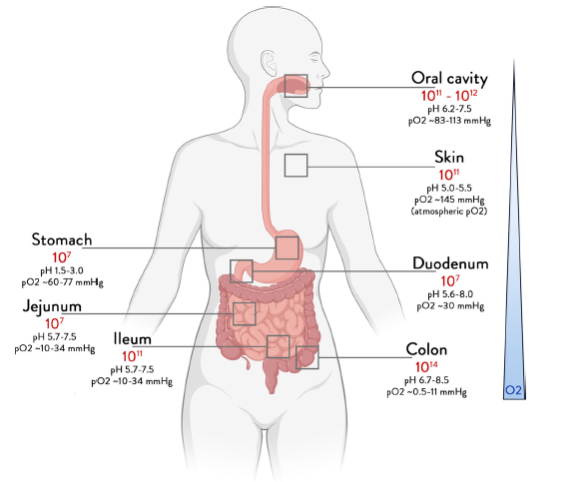
Il microbiota del tratto intestinale è più complesso di quello del resto del corpo ed è costituito da batteri, archaea, funghi, protozoi e alcuni virus. In particolare, quello dell’intestino crasso, poiché il microbiota del colon è di lunga maggiore per numero e diversità rispetto a quello dell’intestino tenue (De Vos et al ., 2022; vedi figura 1).
Il microbiota intestinale dipende da molti fattori. È influenzato dalla genetica, dal microbiota materno, dai microrganismi che vivono nel nostro corpo, dalla dieta, dall’esercizio fisico e persino dall’umore della persona.
Il microbiota umano e la sua composizione genetica (il microbioma umano) hanno cominciato ad essere studiati su larga scala già da alcuni anni nell’ambito di grandi progetti come lo Human Microbiome Project (HMP), negli Stati Uniti, e la Metagenomics of the Human Intestinal Tract , finanziato dalla Commissione Europea. Ecco perché i progressi scientifici legati allo studio del microbiota non cessano di verificarsi.
Cambiamenti con l’età
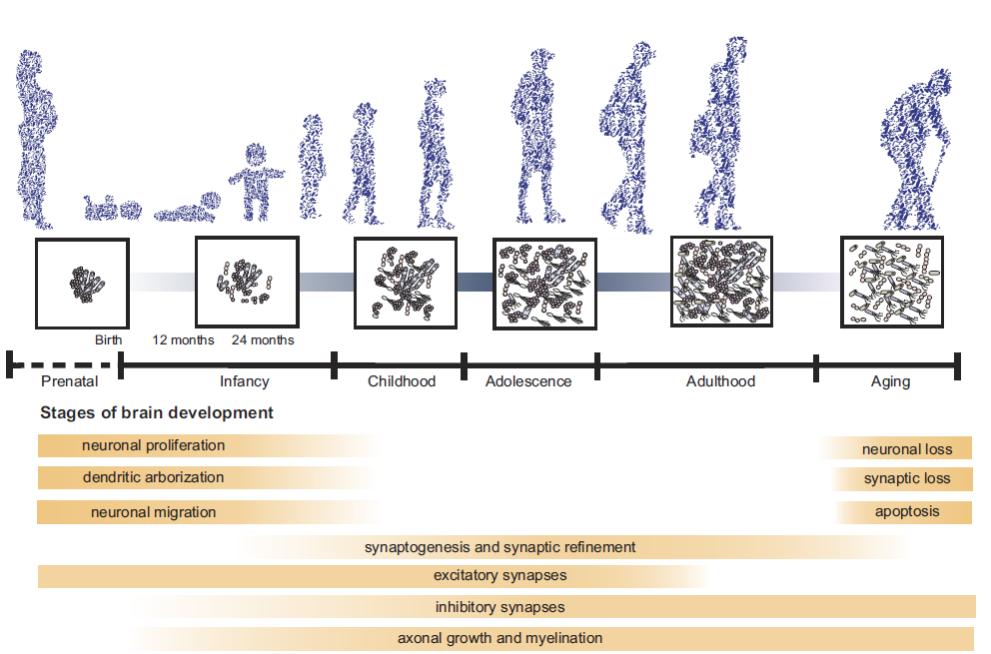
Le persone cambiano nel tempo. Lo stesso accade con il microbiota intestinale. Lo acquisiamo alla nascita attraverso la trasmissione dalla madre e cambia nel corso della vita con i corrispondenti processi neuronali legati a ciascuna delle fasi (vedi figura 2). Sono state osservate variazioni anche piccole del microbiota intestinale nel corso della giornata (Costello et al ., 2009).
In un parto naturale, i lattobacilli presenti nella vagina della madre saranno i primi batteri a colonizzare il bambino, insieme ad altri microrganismi. Mentre in un parto cesareo i primi microrganismi arriveranno dai guanti del personale sanitario e da altre zone della sala parto impossibili da sterilizzare completamente. Per questo motivo in alcuni ospedali si usa strofinare sulla pelle del bambino una garza imbevuta dei fluidi vaginali della madre.
Batteri importanti come i bifidobatteri impiegano più tempo a colonizzare il tratto digestivo dei bambini nati con taglio cesareo rispetto a quelli nati con parto vaginale (Zhang et al. , 2021). I bambini hanno bisogno di questi batteri per svilupparsi correttamente, soprattutto a livello neuronale.
Studi condotti su topi allevati in un ambiente privo di germi hanno dimostrato che sono più ansiosi e presentano deficit cognitivi (Cryan e Dinan, 2012), come discuteremo più avanti. Oltre alla trasmissione durante il parto, il microbiota può trasmettersi anche attraverso i rapporti con altre persone o animali, alimenti o anche oggetti con cui il bambino è in contatto. Per quanto riguarda la questione sociale, è stato dimostrato che i bambini nati in famiglie numerose hanno un microbiota più complesso e sano. Infatti, le persone che vivono insieme presentano una maggiore diversità microbica rispetto a quelle che vivono da sole (Sherwin et al ., 2019). Sebbene anni fa si credesse che il bambino iniziasse ad acquisire batteri all’interno dell’utero della madre, attualmente è dubbio che i batteri completi passino dalla madre al feto (De Goffau et al. , 2019). Sappiamo però che lo sviluppo prenatale è influenzato dal microbiota materno, che può influenzare la dieta, lo stress, l’igiene, il fumo, ecc. (Sinha et al ., 2023; vedere figura 3)
Oltre alla trasmissione durante il parto, il microbiota può trasmettersi anche attraverso i rapporti con altre persone o animali, alimenti o anche oggetti con cui il bambino è in contatto.
Per quanto riguarda la questione sociale, è stato dimostrato che i bambini nati in famiglie numerose hanno un microbiota più complesso e sano. Infatti, le persone che vivono insieme presentano una maggiore diversità microbica rispetto a quelle che vivono da sole (Sherwin et al ., 2019). Sebbene anni fa si credesse che il bambino iniziasse ad acquisire batteri all’interno dell’utero della madre, attualmente è dubbio che i batteri completi passino dalla madre al feto (De Goffau et al. , 2019). Sappiamo però che lo sviluppo prenatale è influenzato dal microbiota materno, che può influenzare la dieta, lo stress, l’igiene, il fumo, ecc. (Sinha et al ., 2023; vedere figura 3)
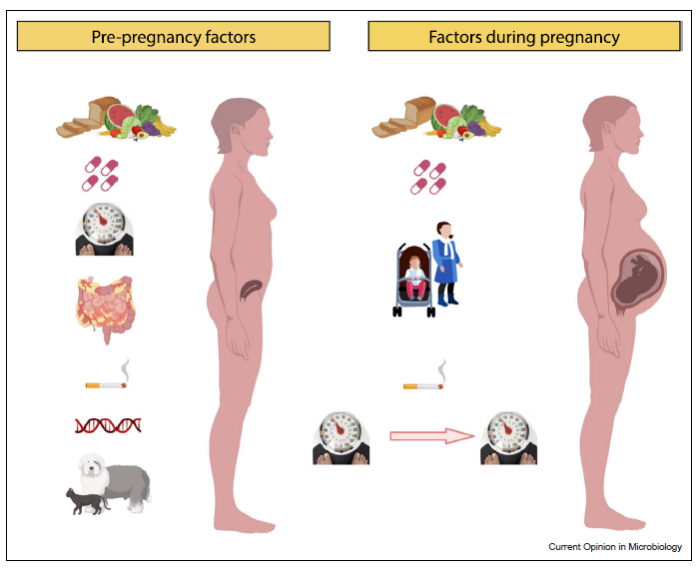
Figura 3. Fattori che possono influenzare prima e durante la gravidanza (Sinha et al ., 2023).
Al di là della genetica (che conta sempre), sono stati identificati una serie di fattori ambientali che regoleranno il microbiota intestinale e saranno essenziali per una buona salute generale. Il principale fattore di impatto sul microbiota è la dieta, ed è fondamentale adattarla alle esigenze individuali (grande sfida della medicina personalizzata). Nella prima infanzia, l’allattamento al seno gioca un ruolo molto importante. Il latte materno contiene oligosaccaridi (costituenti delle fibre), carboidrati complessi che favoriscono lo sviluppo di bifidobatteri che saranno essenziali per formare il microbiota del bambino.
Il latte materno contiene nutrienti e fattori di riconoscimento immunitario che proteggono dalle infezioni intestinali in un momento in cui il microbiota ha una bassa diversità e non è ancora preparato a difendere il bambino dalle infezioni. Studi longitudinali con bambini allattati al seno suggeriscono che l’allattamento al seno può apportare benefici ai circuiti neurali che intervengono nello sviluppo cognitivo, sociale ed emotivo del bambino (Victoria et al. , 2016). La secrezione di ossitocina (ormone legante) nel cervello durante l’allattamento al seno potrebbe svolgere un ruolo. E l’allattamento al seno è molto più che allattare al seno.
D’altra parte, altri fattori importanti che possono avere un impatto sul microbiota intestinale sono l’esercizio fisico, che può migliorarne la composizione e la capacità funzionale, indipendentemente dalla dieta, dall’ambiente in cui cresciamo (quanto è importante la natura), dall’assunzione di farmaci , eccetera.
Per quanto riguarda gli antibiotici, è stato dimostrato che la loro somministrazione alla madre prima o durante il parto modifica i batteri che il bambino riceve (Ratsika et al. , 2023). Durante la prima fase della vita si genera l’omeostasi intestinale necessaria per il buon funzionamento del sistema metabolico e immunitario. Oltre a ciò, anche il microbiota intestinale svolge un ruolo rilevante nello sviluppo del cervello.
Nel caso dell’adolescenza, le abitudini alimentari possono fare una grande differenza. In molti casi, lo squilibrio nutrizionale può portare a problemi gastrointestinali. E lo stress può danneggiare in modo specifico sia il proprio microbiota che il proprio cervello, poiché in questa importante fase della vita non sono stati sviluppati i meccanismi di regolazione emotiva adeguati a causa del mancato sviluppo di circuiti specifici della corteccia prefrontale.
In età adulta un problema ricorrente è l’eccessiva sedentarietà che, purtroppo, spesso si accompagna ad un’alimentazione inadeguata. Oggi mangiamo molto e molte volte, il che porta a mangiare troppo e cibo carente di nutrienti. Come vedremo in un paragrafo successivo, le alterazioni nella composizione del microbiota intestinale sono associate a diverse malattie croniche, tra cui l’obesità e le malattie infiammatorie.
Esistono studi che dimostrano una chiara associazione tra dieta e invecchiamento, colpendo i principali gruppi di batteri del tratto intestinale. Ad esempio, le diete con alti livelli di zuccheri e grassi producono una crescita eccessiva di batteri Firmicutes , mentre le diete ricche di fibre (si pensi a verdure e legumi) portano ad un aumento dell’attività dei Bacteroidetes . È dimostrato che non è mai troppo tardi per migliorare il nostro microbiota, anche in età avanzata. Ad esempio, mangiando più fibre (Koh et al ., 2016) o adottando una dieta di tipo mediterraneo, composta da un elevato consumo di verdure, legumi, frutta, noci, olio d’oliva e pesce, e un basso consumo di carne rossa, latticini, grassi saturi e alimenti trasformati, che porta ad un aumento dei Bacteroidetes e una diminuzione dei Firmicutes (Badal et al ., 2020). Una buona dieta può migliorare il nostro microbiota e la nostra salute a tutti i livelli, anche a livello emotivo. Anche se, ovviamente, potrebbero entrare in gioco altri fattori.
In un interessante studio che ha coinvolto 178 anziani (età media 78 anni) non in cura con antibiotici, è emerso che le persone ricoverate in case di cura e sottoposte a diete monotone e povere di fibre avevano una diversità microbica inferiore rispetto a coloro che vivevano nel loro ambiente familiare, essendo più fragili e con condizioni di salute più precarie (Claesson et al ., 2012).
Oltre alla dieta, intervengono sicuramente altri fattori socio-emotivi che, pur avendo un’influenza specifica in età avanzata, possono influenzarci in qualsiasi fase della vita.
Connessione tra cervello e intestino.
Il cosiddetto asse intestino-cervello si riferisce alla comunicazione bidirezionale che è stata individuata tra il sistema nervoso centrale e il microbiota intestinale attraverso molteplici canali neurali (tramite neurotrasmettitori attraverso il nervo vago), immunitari (con citochine), endocrini (con ormoni come cortisolo) e metabolici (ad esempio, attraverso gli acidi grassi a catena corta che alcuni batteri producono quando consumano fibre o attraverso il metabolismo del triptofano) (vedi figura 4). Da un lato, il microbiota intestinale influenza il funzionamento del cervello e, dall’altro, l’attività cerebrale influisce sulla composizione e sullo sviluppo del microbiota.
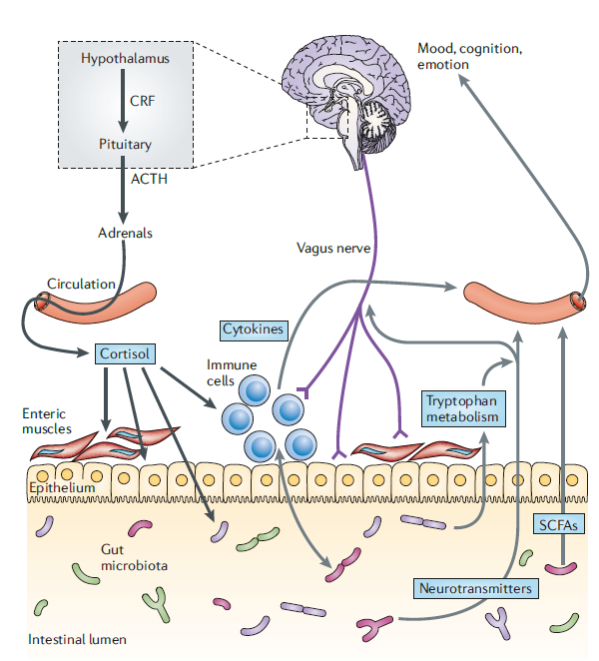
Figura 4. La comunicazione tra l’intestino e il cervello avviene attraverso più canali: nervo vago, citochine, cortisolo, acidi grassi a catena corta (SCFA) o metabolismo del triptofano (Cryan et al ., 2012).
Il tratto gastrointestinale è l’unico organo interno che si è evoluto con un proprio sistema nervoso indipendente: il sistema nervoso enterico . È la rete neurale più estesa al di fuori del cervello. Ecco perché è conosciuto come il secondo cervello . Il sistema enterico è responsabile del funzionamento gastrointestinale di base (motilità, secrezione, flusso sanguigno) e comunica con il cervello (sistema nervoso centrale) attraverso il sistema nervoso simpatico e parasimpatico. Riassumendo possiamo dire che l’asse intestino-cervello è costituito dal microbiota, dal sistema nervoso centrale, dal sistema nervoso autonomo, dal sistema nervoso enterico, dal sistema neuroendocrino e dal sistema neuroimmune.
Il sistema nervoso enterico può avere fino a cento milioni di neuroni. Le cellule immunitarie nell’intestino costituiscono la maggior parte del sistema immunitario del nostro corpo. E le cellule endocrine intestinali sono fondamentali per la nostra salute e il nostro benessere grazie alla loro abbondanza ed efficacia nel comunicare con il sistema nervoso (Furness, 2012).
Dal cervello all’intestino
Il sistema nervoso centrale influenza ed è influenzato dal sistema gastrointestinale. La maggior parte delle ricerche su questa connessione intestino-cervello si è concentrata su come i segnali a monte provenienti dall’intestino e dal suo microbioma alterano la funzione cerebrale. Meno attenzione è stata prestata al modo in cui i segnali discendenti dal sistema nervoso centrale alterano la funzione intestinale. Utilizzando un modello animale, uno studio recente (Levinthal e Strick, 2020) ha identificato specifici percorsi neurali che collegano il cervello allo stomaco, alcuni collegati al sistema nervoso simpatico (attivazione) e altri associati al sistema nervoso parasimpatico (recupero). Le vie parasimpatiche collegano lo stomaco con l’insula anteriore, una regione del cervello coinvolta nell’interocezione (senso dello stato fisiologico del corpo) e nella regolazione delle emozioni. Hanno partecipato anche aree della corteccia prefrontale mediale. Queste regioni, a loro volta, inviano istruzioni all’intestino.
Come hanno spiegato gli autori della ricerca, ciò significa che le nostre intuizioni si costruiscono a partire dalle informazioni sensoriali che provengono dallo stomaco, ma anche attraverso tutte le influenze sull’insula anteriore, come ad esempio le esperienze passate e le conoscenze contestuali. Le tecniche che lavorano sulla consapevolezza del corpo possono aiutare il sistema digestivo attraverso questi percorsi parasimpatici. E, in generale, le buone strategie che migliorano le funzioni esecutive (corteccia prefrontale). Al contrario, le vie simpatiche del sistema nervoso centrale, che si attivano quando siamo stressati, collegano principalmente lo stomaco con la corteccia motoria primaria, coinvolta nell’esecuzione del movimento, insieme alla corteccia somatosensoriale primaria e alla corteccia motoria secondaria. corteccia. Come ricordano anche gli stessi autori della ricerca, è sempre più frequente che i cosiddetti disturbi funzionali gastrointestinali, generati da molteplici situazioni stressanti, resistano ai trattamenti convenzionali, soprattutto a quelli gravi. A questo scopo potrebbe essere utile l’uso della stimolazione transcranica non invasiva da sola o combinata con terapie cognitive, comportamentali e basate sul movimento. Quanto sono importanti l’esercizio fisico, la danza, ecc. L’attività fisica è una fantastica strategia per combattere lo stress e, quindi, per contrastare la comparsa delle ulcere allo stomaco.
Dall’intestino al cervello
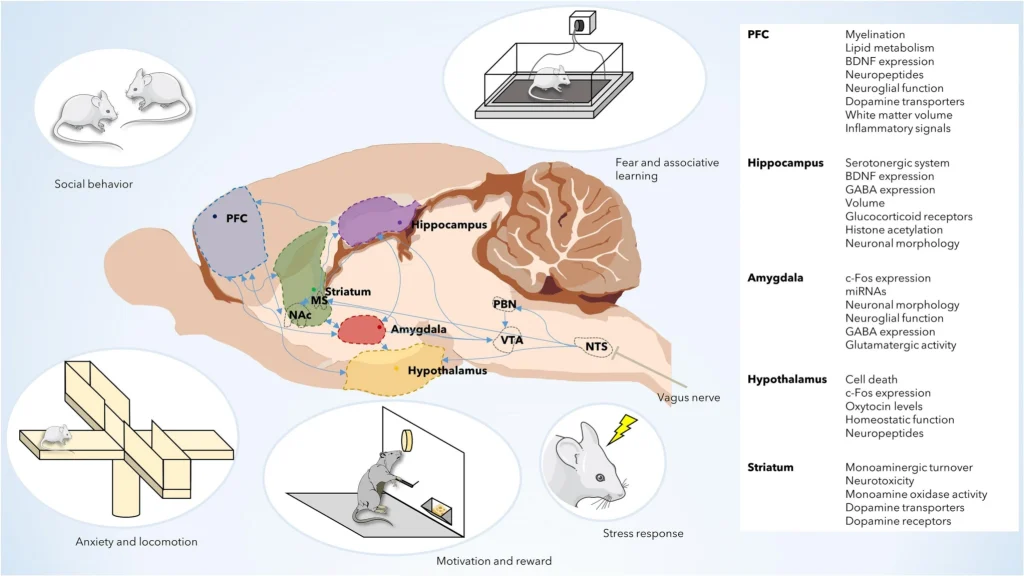
L’intestino comunica con il cervello principalmente attraverso il nervo vago, ma anche attraverso numerose terminazioni nervose intestinali che fanno parte del sistema nervoso periferico. Le fibre del nervo vago, componente principale del sistema nervoso parasimpatico, trasmettono informazioni vitali dai sistemi gastrointestinale, respiratorio e cardiovascolare e forniscono feedback ai visceri. Sebbene nel nervo vago vi sia una predominanza di fibre nervose afferenti (80%), quelle che trasferiscono le informazioni dai recettori sensoriali al sistema nervoso centrale (Bonaz et al. , 2018). La stragrande maggioranza delle cellule digestive e dei recettori codificati come sensazioni intestinali sono strettamente collegate al cervello tramite il nervo vago. Recentemente è stato scoperto un tipo di neuroni intestinali ( cellule neuropodi ) che, come le cellule dell’olfatto e del gusto, sono in grado di estrarre informazioni sui nutrienti e inviare in millisecondi al cervello, attraverso il nervo vago, informazioni sulla qualità nutrizionale degli alimenti. alimenti (Kaelberer et al., 2020). Di conseguenza, possiamo dire che le nostre preferenze alimentari hanno una base inconscia. Queste cellule neuropodi rilevano specifiche molecole nutritive che, generando diversi percorsi neuronali, ci permettono di differenziarle. Sono responsabili, ad esempio, del fatto che gli esseri umani e gli animali preferiscono lo zucchero ai dolcificanti, entrambi dal sapore dolce. Anche i topi privi di recettori del gusto riescono a distinguere lo zucchero dal dolcificante o dall’acqua (Buchanan et al . 2022). Le prove dell’influenza del microbiota intestinale sulla fisiologia del cervello sono emerse principalmente dallo studio di roditori esenti da germi che mostrano alterazioni in vari aspetti della loro neurofisiologia, dalle funzioni sensomotorie intestinali e svuotamento gastrico, all’integrità della barriera, alle funzioni ematoencefaliche e immunitarie (Fülling et al.2019 ). La mancanza di microbiota in questi topi ha colpito regioni critiche come l’ippocampo (memoria), l’amigdala (emozioni), la corteccia prefrontale (funzioni esecutive), l’ipotalamo (risposta allo stress) o lo striato (motivazione). E sono risultati alterati anche i livelli di BDNF (fattore neurotrofico derivato dal cervello), che aumenta con l’attività fisica ed è associato a processi neuronali di base, come la sinaptogenesi o la neurogenesi. Di conseguenza, gli animali senza microbiota mostrano alterazioni nel comportamento e deficit di apprendimento (Sharvin et al., 2023; vedi figura 5).
Figura 5. La completa assenza di comunicazione tra microbiota, intestino e cervello può compromettere il funzionamento di importanti regioni del cervello dei mammiferi (Sharvin et al., 2023).
Sebbene queste indagini indicassero una relazione tra microbiota, cervello e comportamento, prove chiare di questo collegamento provenivano da studi in cui i tratti fenotipici dell’ansia potevano essere trasmessi tra ceppi di animali solo attraverso il trapianto di microbiota intestinale (trapianti fecali). E non solo questo.
Come accenneremo più avanti, diversi studi hanno collegato il microbiota intestinale alla salute e alla malattia. Cambiamenti drammatici nel microbiota intestinale sono stati osservati in pazienti con disturbo dello spettro autistico, schizofrenia, depressione, morbo di Alzheimer, morbo di Parkinson e sclerosi multipla (Morais et al ., 2021).
È interessante notare che, quando si trasferisce il microbiota intestinale di pazienti affetti da queste malattie ad animali esenti da germi, molti dei sintomi iniziano a emergere, il che aggiunge un elemento causale a quello che molti autori già chiamano asse microbiota-intestino-cervello.
Disfunzioni del microbiota
Gli squilibri intestinali sono associati a cambiamenti nella composizione del microbiota che tendono a ridurne la diversità. Questo nuovo stato è chiamato disbiosi microbica . Quando ciò accade, il microbiota ha meno risorse per reagire agli agenti patogeni. La disbiosi microbica è stata osservata in persone con infiammazione intestinale cronica, obesità o sindrome metabolica. Ma anche in persone affette da ansia, depressione, autismo e persino malattie neurodegenerative come il morbo di Parkinson o il morbo di Alzheimer. In questi casi la disbiosi può avere origine da disturbi del comportamento alimentare che colpiscono il microbiota. Ma, allo stesso tempo, gli squilibri nel microbiota possono colpire il cervello e causare disturbi psicologici e comportamentali.
Quando esiste la disbiosi microbica, possono verificarsi disturbi metabolici, immunologici e neuronali. E, al contrario, questi disturbi appaiono solitamente associati alla disbiosi. È l’asse bidirezionale che abbiamo analizzato nella sezione precedente.
Qual è la causa e qual è l’effetto? Non lo sappiamo. Quello che sappiamo è che un’eccessiva permeabilità intestinale può causare molti problemi di salute (allergie, malattie autoimmuni, infiammazioni intestinali, ecc.). In questa situazione, il rivestimento intestinale viene danneggiato consentendo agli agenti patogeni di diffondersi nel nostro sistema circolatorio.
Di conseguenza, le cellule immunitarie causano un’infiammazione sistemica. Sappiamo che lo stress è uno dei fattori che aumenta ulteriormente questa permeabilità.
Anche se va chiarito che tutto dipende dalla dose. Questo è ciò che è noto come ormesi (“ciò che non ti uccide, ti rende più forte”). Piccole dosi di avversità fisiologiche possono essere molto benefiche per la salute, mentre l’eccesso delle stesse avversità può essere tremendamente dannoso. Ad esempio, la restrizione calorica e la fame occasionale fanno bene al microbiota. E lo stesso vale per una breve esposizione al freddo o un po’ di sete. D’altra parte, la maggior parte degli antibiotici sono ad ampio spettro ed eliminano un’ampia varietà di batteri presenti nell’intestino che ci proteggono da altri agenti patogeni (non tutti i batteri sono dannosi). Alcuni di essi non potranno essere recuperati, il che è particolarmente rilevante nelle fasi iniziali della vita in cui lo sviluppo e l’equilibrio del microbiota intestinale non sono ancora adeguati per far fronte alle aggressioni esterne. Pensiamo, ad esempio, alla Salmonella. Quando i nostri batteri riescono a svolgere bene il loro lavoro, possiamo combatterli senza avere sintomi. Tuttavia, i trattamenti antibiotici possono danneggiare il nostro microbiota e lasciarci indifesi contro la Salmonella, che potrebbe verificarsi anche in conseguenza di una malattia o dell’età.
Tornando all’infanzia, in Spagna è stato rilevato un elevato consumo di antibiotici nei bambini sotto i 5 anni, spesso prescritti per processi non batterici (Pérez et al., 2023). Ciò è molto preoccupante perché già nei primi anni di vita si pongono le basi per un buon futuro sistema immunitario. E se l’uso inappropriato di farmaci sta danneggiando il nostro microbiota e, in generale, la nostra salute, lo stesso si potrebbe dire di sostanze come gli interferenti endocrini (bisfenolo A, ftalati, pesticidi, metalli pesanti, ecc.) che sono state associate ad un maggiore incidenza di disturbi metabolici (Gálvez-Ontiveros et al ., 2020). Quando parliamo di microbiota tendiamo subito ad associarlo alla dieta e, sicuramente, è molto importante. Sebbene, come abbiamo già accennato, la salute intestinale non rifletta solo le abitudini nutrizionali, ma sia influenzata anche da molti altri fattori della nostra vita quotidiana (Hou et al., 2022; vedi figura 6) in cui interviene l’ambiente in cui viviamo, il nostro atteggiamento quotidiano, quanto ci muoviamo, come dormiamo, che relazioni abbiamo, i farmaci che assumiamo, ecc. In definitiva, ciò che mangiamo influisce sul microbiota, ma anche ciò che facciamo, pensiamo e sentiamo.
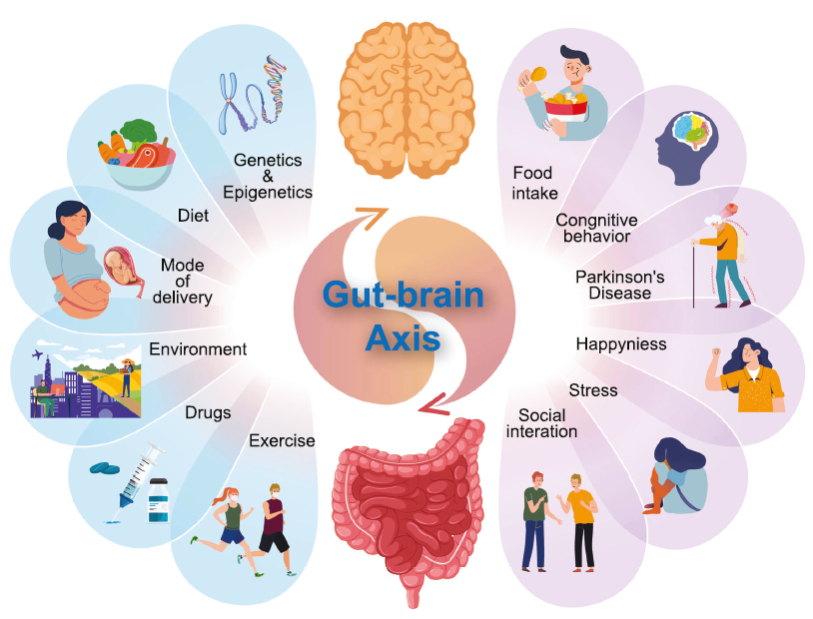
Figura 6. Fattori che influenzano l’asse microbiota-cervello-intestino (Hou et al ., 2022).
Modulazione del microbiota
Sebbene non sappiamo se la disbiosi microbica sia la causa di molte delle patologie menzionate nella sezione precedente, recenti ricerche stanno dimostrando l’importanza di utilizzare strategie che modulino il funzionamento e la composizione del microbiota intestinale. Tra le strategie più studiate ci sono l’uso di probiotici, il consumo di prebiotici e i trapianti fecali. Ci concentreremo sui primi due. Sono spesso utilizzati come integratore alimentare per interventi clinici attraverso la somministrazione orale. Il dosaggio appropriato e l’interazione con il microbiota sono considerati fattori importanti che influenzano l’efficacia dei probiotici e dei prebiotici.
I probiotici sono microrganismi (come bifidobatteri e lattobacilli) che possiamo ottenere naturalmente da alimenti fermentati, come gli yogurt. Assunti in quantità adeguate possono aumentare la diversità del microbiota intestinale. I microrganismi commercializzati come probiotici comprendono batteri di diversi generi (lattobacilli, bifidobatteri, ecc.) e lieviti ( Saccharomyces , per esempio). Sono stati ottenuti benefici nel transito intestinale, contro la diarrea o la sindrome dell’intestino irritabile, ad esempio. Oggetto di studio è il potenziale utilizzo terapeutico in altre patologie (obesità, insulino-resistenza, ansia, ecc.).
Negli studi preclinici (principalmente con roditori) diversi ceppi migliorano il metabolismo, l’immunità, la funzione endocrina e ritardano l’invecchiamento, partendo dal presupposto che la dieta e il microbiota stesso possono influenzare il probiotico (Cunningham et al. , 2021). Forse l’effetto più intrigante di alcuni probiotici è l’impatto sulla funzione cerebrale. Si chiamano psicobiotici . Questi probiotici modulano specificamente l’asse intestino-cervello e possono migliorare la salute mentale, compresa l’ansia o la depressione (Cryan et al ., 2019).
Questi batteri sono in grado di aumentare la produzione di neurotrasmettitori come GABA e serotonina, che influenzano la funzione cerebrale attraverso il nervo vago. Sia i lattobacilli che i bifidobatteri, due delle famiglie di batteri più abbondanti nel nostro colon, producono GABA, un importante neurotrasmettitore che ha effetti inibitori sul cervello. La sua disfunzione è implicata in diversi disturbi mentali (Ullah et al ., 2023). In effetti, molti farmaci anti-ansia, come il Valium, imitano i meccanismi di segnalazione del GABA. La somministrazione di alcuni batteri probiotici può produrre effetti simili, aumentando le concentrazioni di GABA o dei suoi recettori nel cervello. Nel colon, le specie Streptococcus ed Escherichia producono serotonina, un neurotrasmettitore importante, ad esempio, per la digestione, l’appetito, il sonno e l’umore.
Oltre il 90% della serotonina totale presente nell’organismo viene sintetizzata nelle cellule intestinali a partire dal triptofano che ingeriamo con il cibo (Cryan et al ., 2019), sappiamo infatti che una dieta carente di triptofano (le fonti principali sono le uova) e latte, seguito da pesce e carne; è abbondante anche nei cereali integrali) riduce i livelli di serotonina nel cervello. Allo stesso modo, è stata identificata una perdita di diversità nel microbiota intestinale in persone con sintomi di ansia o depressione e bassi livelli di serotonina circolante. Gli inibitori selettivi della ricaptazione della serotonina sono farmaci ampiamente utilizzati come antidepressivi poiché bloccano il riassorbimento della serotonina nei neuroni. Sicuramente parte del successo di questi farmaci ha a che fare con il loro effetto sul microbiota. Negli ultimi anni sono stati testati psicobiotici che aumentano la produzione di serotonina. Ad esempio il Bifidobacterium longum e il Lactobacillus bulgaricus che sono naturalmente presenti nello yogurt e nel kefir (Cryan et al ., 2020).
La speranza è che gli psicobiotici possano finalmente essere usati con la stessa facilità con cui il Prozac viene ora utilizzato per curare la depressione, o il Valium viene ora utilizzato per trattare l’ansia, ma con minori effetti collaterali.
Per quanto riguarda i prebiotici, sono componenti alimentari non digeribili, presenti naturalmente o aggiunti, che esercitano un effetto benefico stimolando selettivamente la crescita e/o l’attività di alcuni batteri nel colon. È la fibra che funge da alimento per i probiotici. Ecco perché li troviamo nelle verdure come indivia, carciofi, porri e aglio, nei cereali integrali, ecc. Affinché una sostanza possa essere considerata prebiotica devono essere documentati gli effetti benefici sulla salute (Gibson et al ., 2017).
Gli studi hanno confermato che l’assunzione di prebiotici può stimolare l’arricchimento selettivo di probiotici nel tratto intestinale, regolando così la risposta immunitaria e prevenendo gli agenti patogeni. I prebiotici più conosciuti sono l’inulina, i fruttooligosaccaridi, il lattulosio e i galattoligosaccaridi. Un prebiotico in fase di studio di cui si parla molto ultimamente e che sembra interessante è l’amido resistente. E vengono studiati anche prebiotici non carboidrati che includono polifenoli, acidi grassi e altri micronutrienti. Poiché probiotici e prebiotici sono economici e facili da maneggiare, vengono spesso utilizzati nelle persone con malattie neurodegenerative. L’integrazione a lungo termine con latte arricchito con bifidobatteri e Lactobacillus fermentum ha avuto un impatto positivo sulla memoria e sull’apprendimento nei pazienti con Alzheimer (Bonfili et al., 2021). Migliora pensando al microbiota
Nel corso della vita, più il microbiota è ricco e diversificato, meglio resisterà alle minacce esterne. Il microbiota intestinale rappresenta un ecosistema in cambiamento che viene messo a dura prova da molti fattori, come una dieta sbilanciata, lo stress, l’uso di antibiotici o le malattie. L’intenso scambio di informazioni tra cervello, intestino e il suo microbiota avviene ventiquattr’ore su ventiquattro, dalla nascita alla morte. Tutte queste informazioni coordinano le funzioni digestive di base, ma hanno anche un impatto sulle nostre prestazioni quotidiane: come ci sentiamo, come ci relazioniamo, quali decisioni prendiamo, quanto mangiamo… e molto altro ancora. Comprendere questo dialogo continuo può guidarci verso una salute ottimale.
Cosa possiamo fare al riguardo? Come possiamo nutrire il microbiota affinché la nostra salute migliori? Il grande neuroscienziato Emeran Mayer, nel suo fantastico libro “Pensare con lo stomaco: come la relazione tra digestione e cervello influisce sulla salute e sull’umore” , propone quanto segue:
– Incoraggiare la diversità microbica massimizzando l’assunzione regolare di alimenti fermentati naturali e probiotici.
– Ridurre il potenziale infiammatorio del microbiota intestinale prendendo migliori decisioni nutrizionali.
– Ridurre i grassi animali dalla dieta.
– Evitare il più possibile gli alimenti trasformati prodotti in serie e scegliere alimenti coltivati biologicamente.
– Mangiare porzioni più piccole.
-Prendere in considerazione la nutrizione prenatale.
– Ridurre lo stress e praticare la consapevolezza di sé.
– Evitare di mangiare quando siamo stressati, arrabbiati o tristi.
– Godere dei piaceri segreti e degli aspetti sociali del cibo.
– Diventare esperti nell’ascolto di ciò che sentiamo nelle nostre viscere.
Il microbiota è solo uno dei pilastri fondamentali di una vita sana. Ne è, allo stesso tempo, causa ed effetto. Dobbiamo prenderci cura di noi stessi in modo completo.
Ecco come funziona il cervello. E conosciamo i pilastri fondamentali per una buona salute del cervello . Questi pilastri sono essenziali anche per il mantenimento di un buon microbiota intestinale. Lo diceva già Virginia Wolf: “Non si può pensare bene, amare bene, dormire bene, se non si è mangiato bene”. Insomma, non si può vivere bene.
Ogni volta che mangiamo dobbiamo avere fiducia che l’intestino prenda le decisioni giuste per permetterci di continuare a vivere.
Autore: Jesus C. Guillén
Fonte: https://escuelaconcerebro.wordpress.com/author/jesuscguillen/